【アニメgif】 中和の実験とイオンの個数の変化
「酸とアルカリを中和させると、水と塩(えん)ができる」現象について、アニメgifで動画を作ってみました。合わせて「中和していく過程でイオンの数がどう変化するか」という定番問題についても考えてみたいと思います。
まず、酸とアルカリの確認からですが
- 酸性の水溶液は水素イオン(H+)を生じる
- アルカリ性の水溶液は水酸化物イオン(OH–)を生じる
ということで、この2つの水溶液を混ぜると中和が起きて、水が生じます。
H+ + OH– → H2O
中和によって、酸のH+「じゃない」方のイオンと、アルカリのOH–「じゃない」方のイオンが取り残されます。この余ったイオンどうしが化合物になったものが「塩」です。
高校入試では主に、次の2つの中和の実験について出題されますので、順番に見ていきましょう。
- 塩酸と水酸化ナトリウム
- 硫酸と水酸化バリウム
塩酸と水酸化Naの反応
まずは、水酸化ナトリウム(NaOH)水溶液に塩酸(HCl)を加えたときの反応です。この2つは水溶液中で次のように電離しています。
- NaOH → Na+ + OH–
- HCl → H+ + Cl–
普段「塩酸」と呼んでいる水溶液は、塩化水素という気体を水に溶かしたものです。この2つを中和させると、H+とOH–が水になり、余ったNa+とCl–は塩化ナトリウム(NaCl)という塩を作ります。
塩化ナトリウムというと食塩ですから、私が中学生の頃は(20年ほど前?)中和させた液体を蒸発させて舐めてみるというのを実験でやった記憶があります。さすがに今ではそんなことしたらマズいと思うのですが、このときの反応式は次の通りです。
HCl + NaOH → H2O + NaCl
ということでこの反応は、理科室でよく行われる定番の実験ですが、ここで次のような場面を想定して、アニメgifにしました。
「うすい水酸化Na水溶液にBTB溶液を加え、うすい塩酸を一定量ずつ混ぜる実験を数回繰り返したところ、2回目で水溶液が緑色になった」
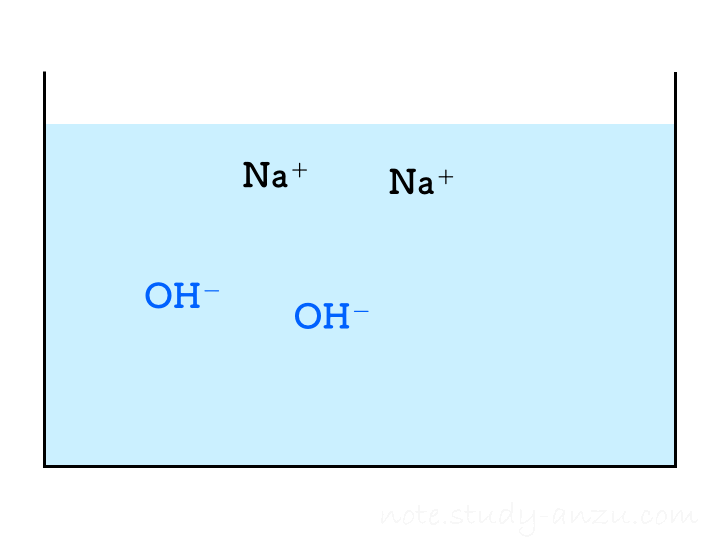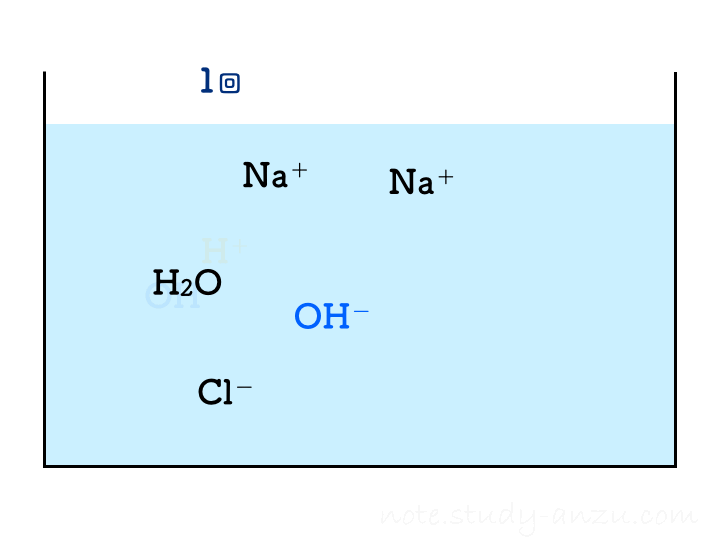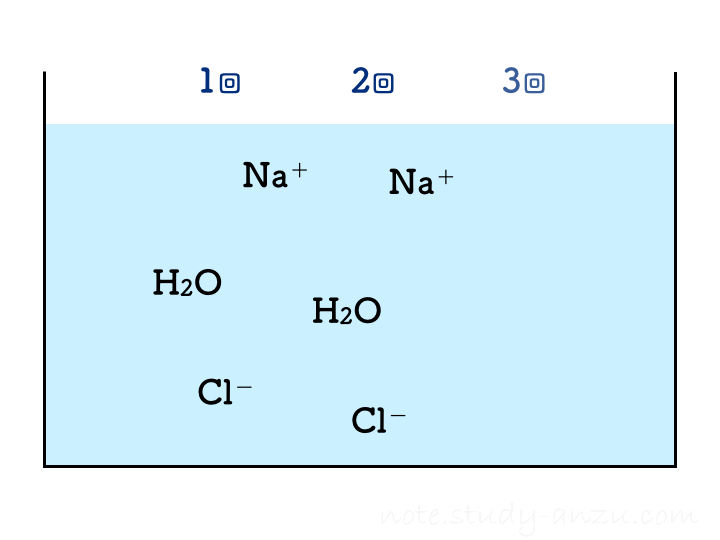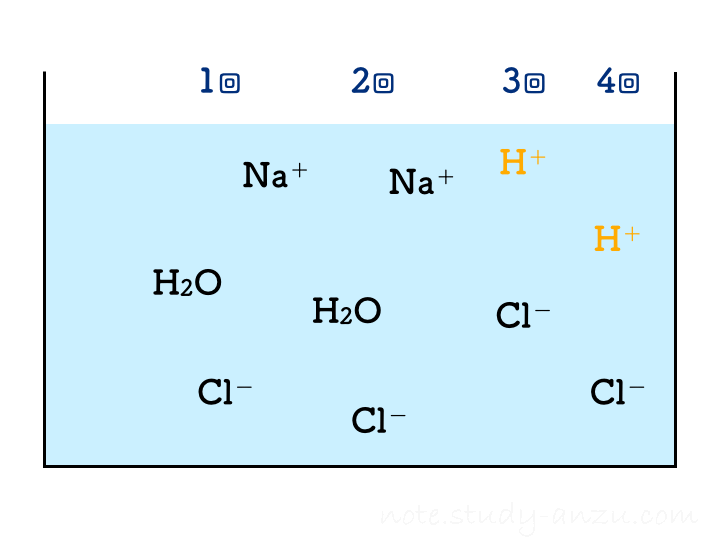
ということで、塩酸の濃度と注入量をうまい感じに調整して、2回目の注入で中性になるようにした場合のイメージ図がこちらです(本当は、BTB溶液の色が青→緑→黄色になっていくのですが、イオンの結びつき方に注目してもらうため省略しました)。
1回目の注入ではまだ水酸化物イオンが残っておりアルカリ性を示しますが、2回目の注入でH+もOH–もきれいに消えて中性となります。3回目以降は塩酸のH+が増えるだけですからどんどん酸性が強くなる、という流れです。
さて、テストで質問されるのは、この一連の手順で「イオンの数がどう変化していくのか」ということです。これについては次の表をご覧ください。
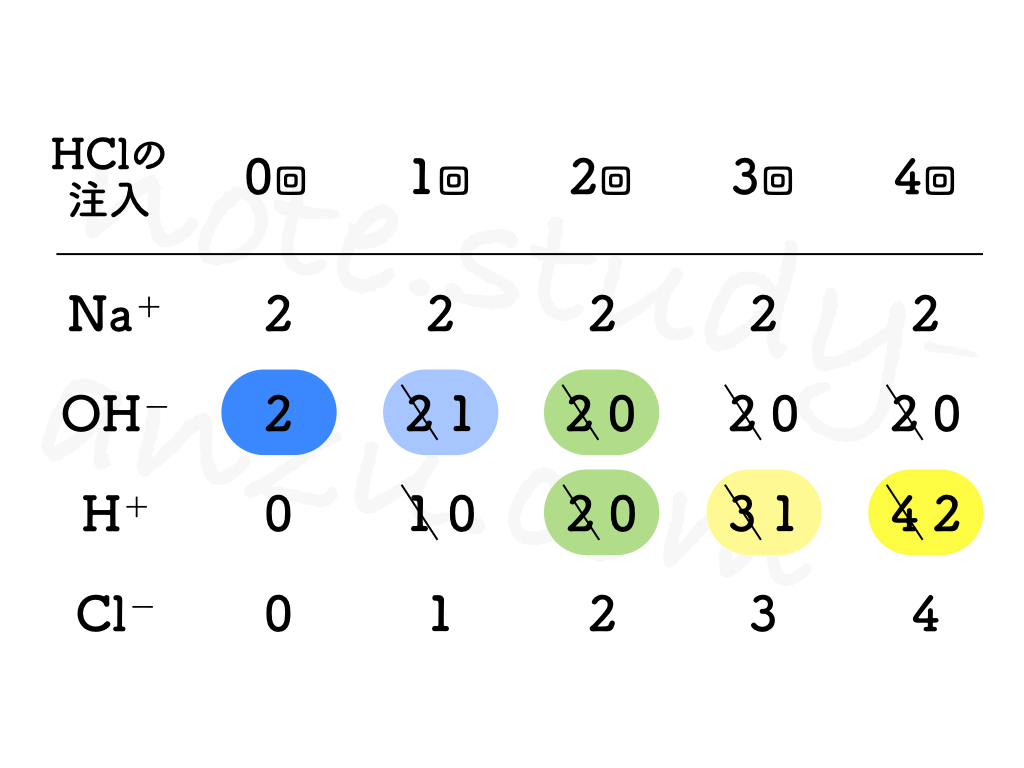
実際の水溶液中には、ゼロが数十個つくほどの膨大な数のイオンが存在していますが、ここではあくまで図表に書かれている個数をカウントしてみます。H+とOH–で中和が起こり、同じ数の分だけそれぞれ消えますが、このときOH–が余ればアルカリ性(BTB青色)、H+が残れば酸性(BTB黄色)となります。
- もともとビーカーに入っているNaOH水溶液について
- Na+の数はつねに一定
- OH–は中性になるまで減り続け、いったん中性になったらゼロのまま
- 注入していくHCl水溶液について
- H+は中性になるまで全部消えてゼロになり、相手となるOH–がいなくなってからはどんどん増えていく
- Cl–は注入した分だけ増え続ける
と考えればOKです。
硫酸と水酸化Baの実験
もう1つ出題されやすい反応、水酸化バリウム(Ba(OH)2)水溶液に硫酸(H2SO4)を加えたときの反応も見てみます。この2つの電離は、
- Ba(OH)2 → Ba2+ + 2OH–
- H2SO4 → 2H+ + SO42-
と表され、H+やOH–の個数が倍になりますので要注意です。この2つを中和させると水のほかに、塩として「硫酸バリウム」という物質(BaSO4)が出てきます。こちらは水にほとんど溶けないため、白い沈殿となって水溶液がにごっていきます。この反応は
H2SO4 + Ba(OH)2 → 2H2O + BaSO4
です。これもアニメgifにしましたが、1回の注入でH2Oが2個分できることに注意して見てみてください。
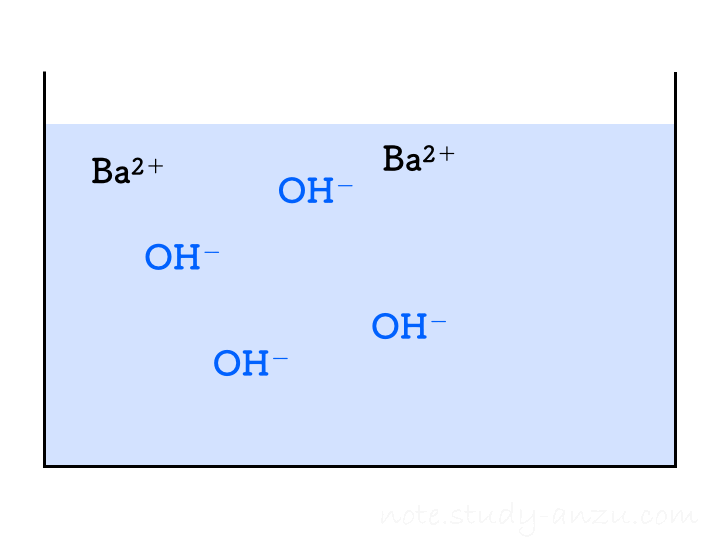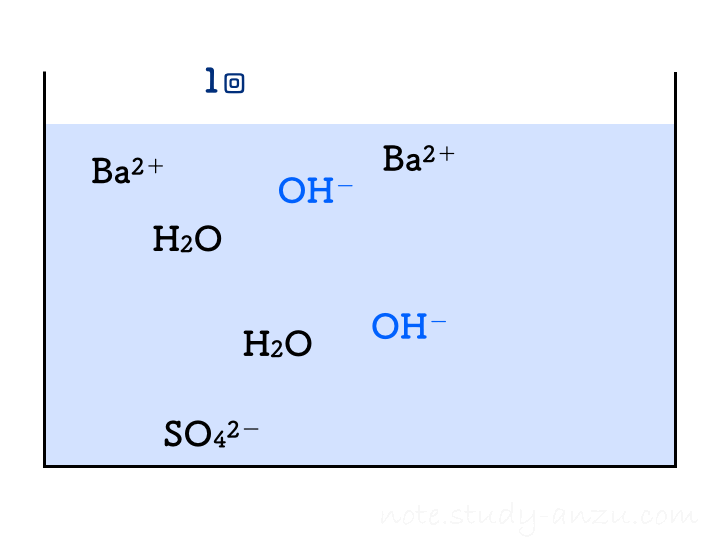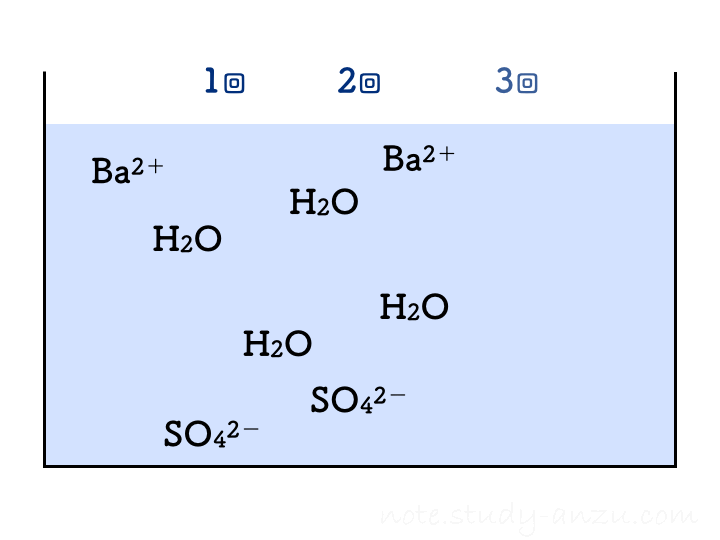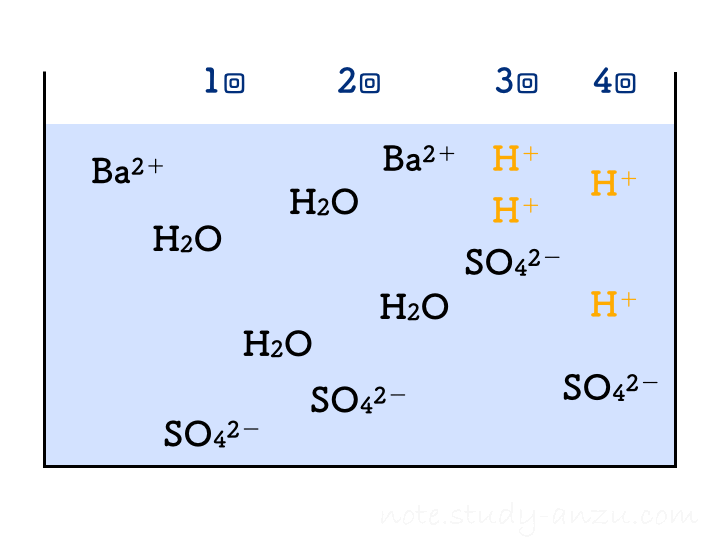
先ほどと同様に、イオンの個数についても確認です。
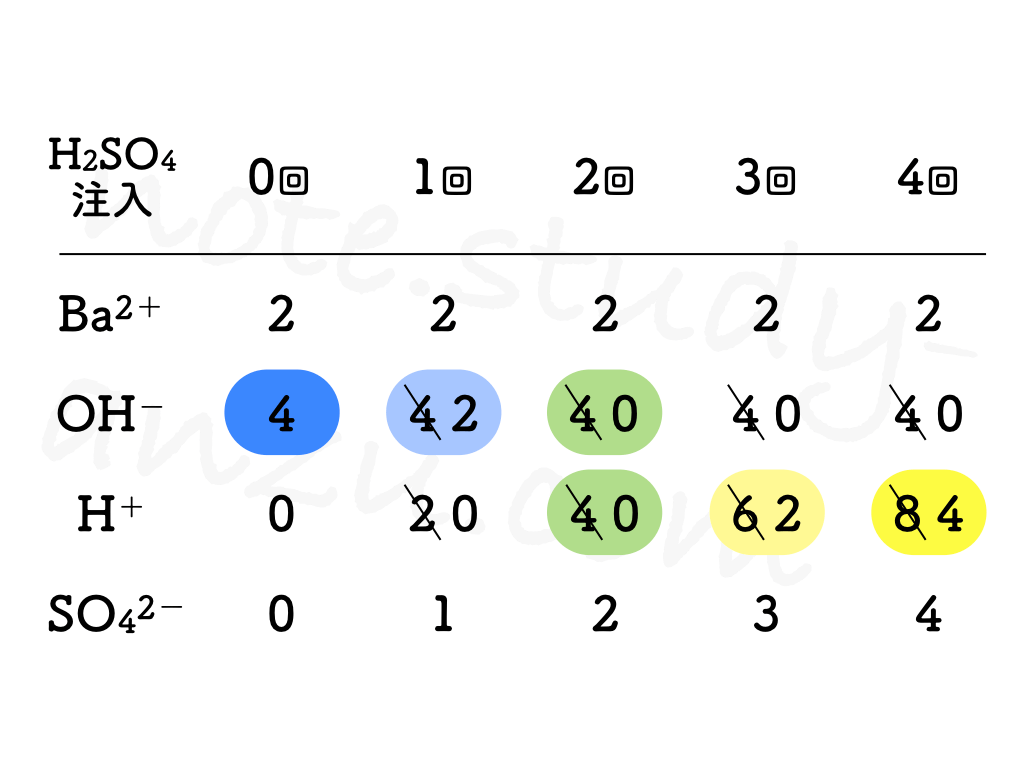
- もともとビーカーに入っている Ba(OH)2 水溶液について
- Ba2+の数はつねに一定
- OH–は中性になるまで減り続け、いったん中性になったらゼロのまま
- 注入していくH2SO4について
- H+は中性になるまで全部消えてゼロになり、相手となるOH–がいなくなってからはどんどん増えていく
- SO42-は注入した分だけ増え続ける
今回は表の形でまとめましたが、実際のテスト問題では「イオンの数の変化を正しく表したグラフはどれか」という風に、グラフを選ばせる出題がよく出てきます。