【アニメgif】ダニエル電池の仕組みを図解
令和3年からの新しい教科書では、中学3年生の化学分野で「ダニエル電池」を学習します。ということで、急きょアニメgifつきの図解ページを作成しました。まず、ダニエル電池を作る上で必要なものは以下の通りです。
- 亜鉛と銅、2種類の金属板を用意
- 亜鉛の極には硫酸亜鉛の水溶液を、銅の極には硫酸銅の水溶液を入れる
- 2つの水溶液が混ざらないように、でもイオンの行き来はできるようにするため、素焼き板などで仕切りをする
素焼き板というのは、植物を植える鉢(プラスチックじゃなくて、陶器のもの)のような材質の板と考えればOKです。こうしてできた電池は、次のような電子の移動が起こります。
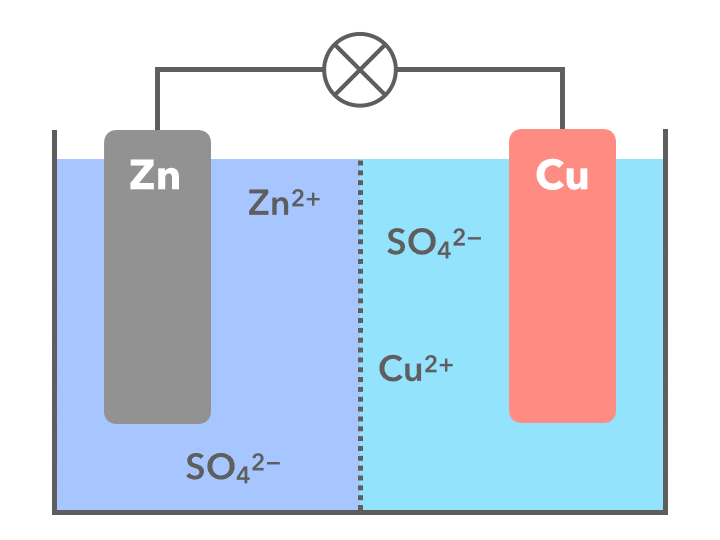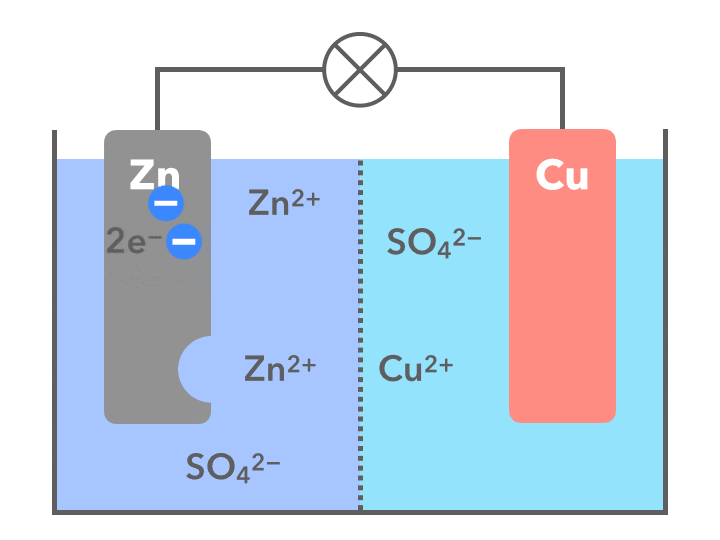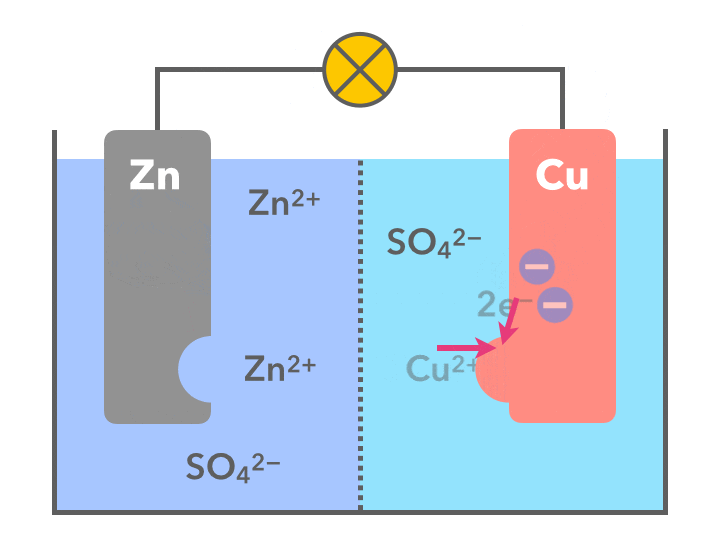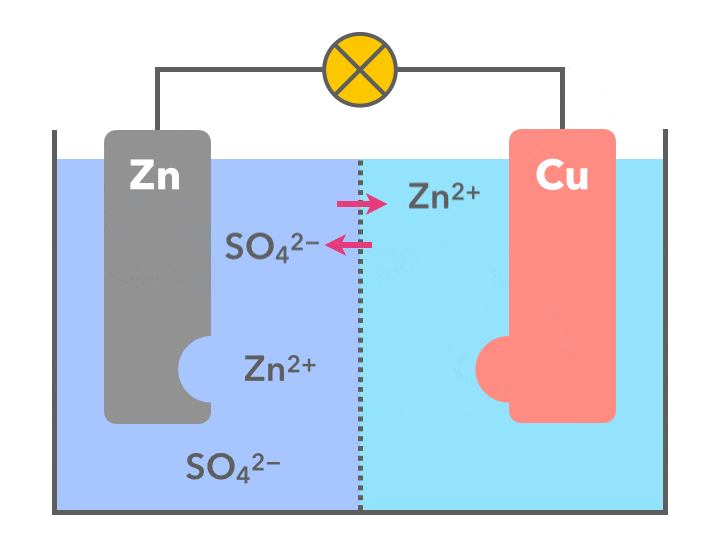
ダニエル電池で起こっていることを簡潔にまとめると
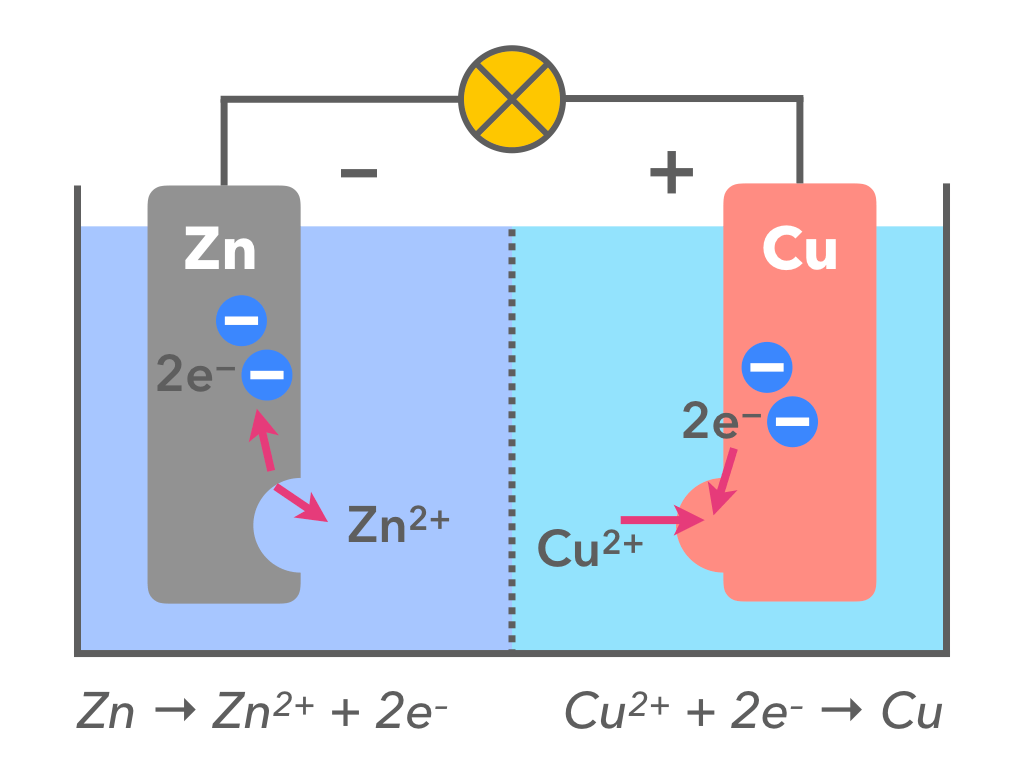
- まず、亜鉛と銅では亜鉛の方がイオンになりやすい(イオン化傾向が大きい)ため、亜鉛が電子を2個手放して陽イオンZn2+となり、水溶液中に溶け出す(図の左側)
- 化学式: Zn → Zn2+ + 2e–
- 電子は導線を伝わって反対側、銅板の極の方へ移動する
- 電流は電子の移動と逆方向と決まっている。電流はプラスからマイナスの向きだから、銅板(図の右)側が正極、亜鉛版(図の左)は負極となる
- 銅板側(図の右側)では、水溶液中の銅イオン(Cu2+)がやって来た電子2個を受け取り、銅のカタマリとなって銅板に付着する
- 化学式: Cu2+ + 2e– → Cu
- 負極(左側)では数の増えてきた亜鉛イオン(Zn2+)が板をすり抜け正極へ移り、銅板側では、銅イオンというパートナーを失った硫酸イオン(SO42-)が負極側へ移動する
起こっている化学反応について、もう一度図で確認してみましょう(下の画像は動きません)
電子が「e–」ですね。マイナスの電気を帯びています。反対に陽イオンは、プラスの記号なので何かが多いようなイメージに感じるかもしれませんが、そうではなくて電子を奪われたためにマイナス不足となり、電気的にプラスに傾いている状態になります。
上では、電子の動きと電流の向きは反対だと書きましたが、これは電子が発見される前の時代に「電流はプラスからマイナスに流れる」と勝手に決めてしまったので、今でもそのように取り扱っているということです。
(イオンの分野では、中和とイオンの個数についてのアニメgif図解も作っていますので合わせてご覧下さい。)